中国EGFR单抗的研究进展

一、抗EGFR单克隆抗体
EGFR在人类多种癌症中呈现异常,包括表达水平上升、翻译后修饰紊乱及序列突变。在超过80%的头颈癌患者、超过50%的结直肠癌患者以及超过三分之一的非小细胞肺癌、前列腺癌或卵巢癌患者癌细胞中发现EGFR的过度表达。分子生物学实验方法分析证实,癌细胞中EGFR表达量极高,可达每细胞200万个,是正常细胞的20至50倍。EGFR在不同肿瘤组织中的表达水平也存在较大差异,与肿瘤的分化程度、恶性程度、浸润程度密切相关1-2。
全球主要有4个EGFR单抗3-4:
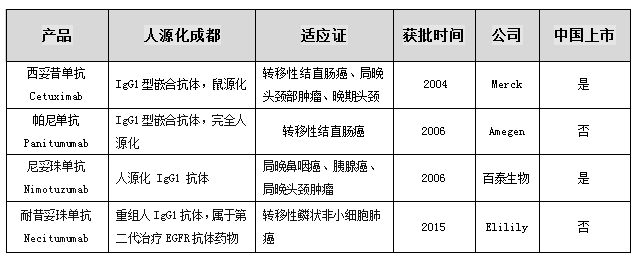
市场销售数据显示,默克西妥昔单抗依然保持重磅药物的市场地位。2017—2019年西妥昔单抗的全球销售额从16.1亿美元下降到了15.2亿美元,2020年保持平稳,2021年迅速增长至17.0亿美元,去年略微下降至16.4亿美元。而根据开思数据库,随着适应证的扩大和肠癌头颈医保可报销,在中国市场,西妥昔单抗迅速放量,从2017的5亿元销售额增长至2021年的20.2亿元。2022年销售额稍有下降,维持在20.1亿元。
二、西妥昔单抗和西妥昔生物类似物/改良型生物制品
西妥昔单抗是德国默克里昂制药公司生产,2005年12月,中国SFDA批准爱必妥™联合伊立替康用于治疗经含伊立替康方案化疗失败且表达表皮生长因子受体的转移性结直肠癌5。2019年9月18日,国家药品监督管理局正式批准西妥昔单抗用于RAS基因野生型转移性结直肠癌一线治疗6。2020年3月2日国家药监局批准西妥昔单抗注射液(商品名“爱必妥”)与铂类和氟尿嘧啶化疗联合用于一线治疗复发和/或转移性头颈部鳞状细胞癌(R/M SCCHN)7。2022年6月22日,科技公司默克宣布,爱必妥®(西妥昔单抗注射液)获得国家药品监督管理局(NMPA)批准,与放疗联合用于治疗局部晚期头颈部鳞状细胞癌(LA SCCHN)8。
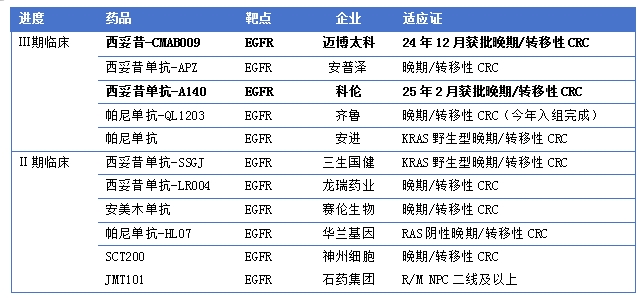
爱必妥在中国的销售,前期以结直肠为主,近几年头颈部的销售也在逐渐增加。2017年国内西妥昔单抗的专利保护到期,国内 EGFR 单抗的临床开发格局以西妥昔单抗类似物为主。
在研的西妥昔生物类似物/治疗用改良型生物制品至少7家,截至现在已有1家西妥昔生物类似物和1家治疗用改良型生物制品均获批上市。2024年6月25日,先声药业集团和迈博药业合作的EGFR抗体药物恩立妥®(通用名:西妥昔单抗β注射液,2.4类改良型生物制品)获批用于RAS/BRAF基因野生型的转移性结直肠癌一线治疗10。恩立妥®在上市后迅速被纳入国家医保目录,自2024年12月起,患者可享受医保政策11。2025年2月7日科伦博泰开发的西妥昔单抗N01注射液(达泰莱®)获批结肠癌12。
生物类似药存在适应症外推的可能,科伦博泰开发的西妥昔单抗N01注射液(达泰莱®)是西妥昔类似物后续很可能快速获批头颈适应症8。在《西妥昔单抗注射液生物类似药临床试验设计指导原则(征求意见稿)》中指出如果在原研药已批准适应症某一个人群中完成了生物类似药的系统对比研究,那么生物类似药有可能基于已有的数据和信息寻求原研药已批准其他相同作用机制适应症的获批9。
西妥昔生物类似物除了沿着原研爱必妥的适应症进行研发外,也在不断拓展新的适应证。2025年2月6日,中国国家药监局药品审评中心官网最新公示,由科伦博泰申报的西妥昔单抗N01注射液与正大天晴申报的格索雷塞片(KRAS G12C抑制剂)联合疗法获批临床,拟定适应症为携带KRAS G12C突变的局部晚期或转移性非小细胞肺癌等恶性肿瘤。
JMT101是石药集团下属津曼特生物科技有限公司自主研发的一种重组人源化抗表皮生长因子受体(EGFR)单克隆抗体,是1类新药。在2024年欧洲肿瘤内科学会亚洲年会(ESMO Asia)上,JMT101联合奥西替尼治疗EGFR经典突变的非小细胞肺癌的临床研究数据亮眼,确认的客观缓解率(ORR)达到78.8%,疾病控制率(DCR)高达81.6%,中位无进展生存期(mPFS)为20.8个月。此外,JMT101+HB1801联合治疗EGFR高表达肺鳞癌的3期临床试验正在进行中。中山大学肿瘤防治中心联合18家中心开展JMT101注射液联合米托蒽醌脂质体注射液治疗既往至少2线治疗失败的复发或转移性鼻咽癌患者的Ⅱ期临床研究,目前主中心项目已经启动。
三、尼妥珠单抗
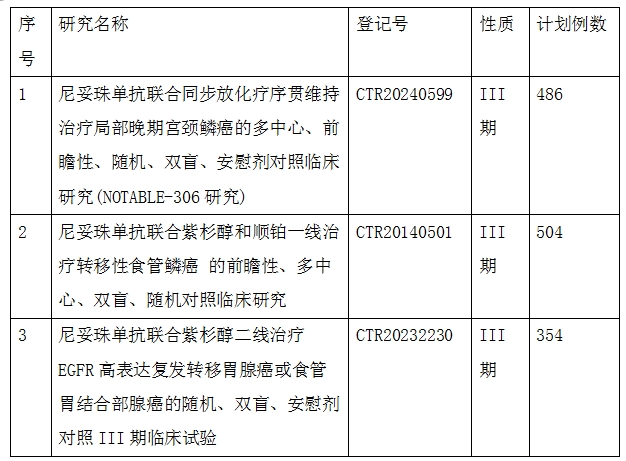
尼妥珠单抗是百泰生物药业有限公司开发的EGFR单抗,商品名称泰欣生。2008年4月,泰欣生®(尼妥珠单抗)正式上市,批准用于治疗鼻咽癌,它是一个以表皮生长因子受体(EGFR)为靶点的人源化单抗药物,它可以在杀伤肿瘤细胞的同时保护正常的人体细胞,具有在治疗方面,特异性强、生物利用度高和副作用小等特点15。2023年6月12日,中国国家药监局(NMPA)官网公示,百泰生物尼妥珠单抗胰腺癌适应症获批,与吉西他滨联合治疗K-Ras野生型局部晚期或转移性胰腺癌16。2024年2月4日,百泰生物宣布尼妥珠单抗新适应症上市申请已获中国国家药监局(NMPA)批准与同步放化疗联合治疗局部晚期头颈部鳞癌17。
尼妥珠单抗现在已经获批三个适应症:
鼻咽癌:与放疗联合治疗III/IV期疾病。
胰腺癌:与吉西他滨联合治疗K-Ras野生型局部晚期和/或转移性疾病。
头颈部鳞癌:与同步放化疗联合治疗局部晚期疾病。
尼妥珠单抗不同的适应症,用法用量上略有差异:
鼻咽癌:将100mg尼妥珠单抗注射液稀释到250mL生理盐水中,静脉输液给药,给药过程应持续60分钟以上。在给药过程中及给药结束后1小时内,需密切监测患者的状况。首次给药应在放射治疗前开始,放疗开始后每周给药1次,连续使用8周18。
胰腺癌:将400mg尼妥珠单抗注射液稀释到250mL生理盐水中,静脉滴注给药,给药过程应持续60分钟以上。在给药过程中及给药结束后1小时内,需密切监测患者的状况。每周1次,直至疾病进展或出现无法耐受的毒性反应18。
头颈部鳞癌:将200mg尼妥珠单抗注射液稀释到250mL生理盐水中,静脉输液给药,给药过程应持续60分钟以上。在给药过程中及给药结束后1小时内,需密切监测患者的状况。首次给药应在放射治疗前开始,放疗开始后每周给药1次,连续使用7周以上18。
除此尼妥珠单抗正在积极拓展宫颈癌、食管癌和胃癌19
四、EGFR单抗的展望
(1)为应对西妥昔可能会面临的集采,EGFR单抗的开发应该拓展新新的领域,例如胃癌、食管癌、宫颈癌和胰腺癌。
(2)为应对不断涌现的创新药物,EGFR单抗应积极寻求高质量的联合开发适应症的机会,与其他产品形成协同效应,如与PD-1抑制剂、B7H3-ADC以及其他双特异性或多特异性抗体进行联合研究。
(3)考虑基于EGFR单抗研发EGFR-ADC或EGFR双抗的可能性

11.《国家基本医疗保险、工伤保险和生育保险药品目录(2024)》
13.《生物类似药相似性评价和适应症外推技术指导原则》
14.《西妥昔单抗注射液生物类似药临床试验设计指导原则(征求意见稿)》
- 中国EGFR单抗的研究进展
- 提升教育感染力,让“大安全”理念深植人心
- 习言道丨同志加兄弟!一图了解习近平到访的这个国家
- "世界超市"热闹依旧 义乌老板用心做"地球人生意"
- 青昀新材全球首发鲲纶防护材料,以颠覆性科技重构防护安全维度
- 探访中兽医门诊:别样的诊疗手法进行望、闻、问、切
- 意识到给美民众带去的痛苦?美方豁免部分商品“对等关税”
- 超22万尾子二代中华鲟放归长江
- 越南学者:中越合作助推中国-东盟自贸区迈向3.0
- 越南学者高度评价:这次访问,让中越命运共同体建设迈上新台阶
- 【聚焦消博】联合飞机集团副总裁孙立业:低空经济将重新定义城市生活场景
- 2025消博会探“新”:服务消费展现大潜能
- 政企合力稳订单拓市场 中国外贸一季度平稳开局
- 刷新纪录!全球最大海上“带货王”来了
- 鲁班工坊环游记:对话世界的职教方舟
- 违法和不良信息举报
- 互联网新闻信息服务许可证10120170006
- 信息网络传播视听节目许可证0108263号
- 京公网安备11010502032503号
- 京网文[2011]0283-097号
- 京ICP备13028878号-6






















































